文章來源:中國食品藥品監管雜志
引用本文
張帆,張志娟,宋瑞霖*.WHO 監管評估體系概況及對我國藥品監管國際化的思考[J].中國食品藥品監管,2024,(7):16-25.
WHO 監管評估體系概況及對我國藥品監管國際化的思考
Overview of WHO Regulatory Assessment System and Reflection on the Internationalization of China's Drug Regulation
張帆
中國醫藥創新促進會
ZHANG Fan
China Pharmaceutical Innovation and Research Development Association
張志娟
中國醫藥創新促進會
ZHANG Zhi-juan
China Pharmaceutical Innovation and Research Development Association
宋瑞霖*
中國醫藥創新促進會
SONG Rui-lin*
China Pharmaceutical Innovation and Research Development Association
摘 要 Abstract
為應對全球復雜監管環境帶來的挑戰,推動醫療產品全球化監管協同,世界衛生組織(WHO)制定了一套統一的全球基準評估工具(GBT),并在此基礎上發布WHO 列名監管機構(WLAs)清單,為監管機構獲得全球認可提供透明且基于證據的途徑。長久以來,我國高度關注與WHO 的交流合作,在疫苗監管和全球化領域已取得了豐碩的成果。在藥品監管領域,我國已重塑了整個藥品監管生態系統,具備了獨立審查創新產品的能力,但在國際社會尚未形成普遍認知。本文從GBT 和WLAs 清單關注的監管透明度建設角度出發,探索分析我國藥品監管體系面臨的挑戰,并提出改進建議,以期助力我國更加深入地融入全球監管協同、監管信賴的國際大趨勢中。
To address the challenges posed by the complex global regulatory environment and promote global regulatory coordination of medical products, the World Health Organization (WHO) has developed a unified Global Benchmarking Tool (GBT) and released a list of WHO-Listed Authorities (WLAs). This provides a transparent and evidence-based path for regulatory agencies to gain global recognition. China has long prioritized exchanges and cooperation with the WHO, achieving fruitful results in vaccine regulation and globalization. In the field of drug regulation, China has reshaped its entire drug regulatory ecosystem and developed the ability to independently review innovative medical products, but these achievements have yet to gain widespread international recognition. From the perspective of regulatory transparency, which is a key focus o the GBT and WLAs, this article explores the challenges faced by China’s drug regulatory system and proposes suggestions to help China more deeply integrate into the international trend of regulatory collaboration and reliance.
關鍵詞 Key words
全球基準評估工具;成熟度水平;世界衛生組織列名監管機構;監管能力評估;監管國際化;國際互信;透明度
Global Benchmarking Tool; maturity level; WHO-Listed Authorities; regulatory capacity assessment; regulatory internationalization; international mutual reliance; transparency
世界衛生組織(World Health Organization,WHO)是聯合國系統內世界衛生問題的指導和協調機構,其職責在于引導全球公共衛生事務,擬定全球衛生研究議程,制定相關規范和標準,向成員國提供所需的技術支撐,以及監測和評估全球衛生趨勢[1]。WHO 官方調查統計顯示,截至2022 年4 月,其194 個成員國中約71% 缺乏能夠滿足人民健康需求的藥品監管體系,且難以耗費大量人力、物力和財力籌建一個運行良好的監管系統,絕大多數國家和地區仍需要依賴其他值得信賴的成熟監管體系國家或地區的監管決策結果作為其藥品注冊審批的參考依據[2]。
對此,早在1997 年,WHO就開始制定并發布評估指標用于評估監管系統的體系和能力,后將其作為申請疫苗預認證(prequalification,PQ) 的先決條件,為欠發達國家和地區藥品監管部門的審批、聯合國采購等提供指引。在多年的評估實踐中,WHO 不斷優化、多次調整其評估指標,于2014 年著手開發適用于藥品和疫苗的統一評估指標,并于2016 年正式引入了藥品和疫苗全球基準評估工具(Global Benchmarking Tool,GBT)(現行為2021 年修訂第六版)。GBT不僅能夠幫助WHO 評估醫療產品的監管制度,各成員國監管部門也能使用其對監管體系進行自評估,以實現提升和改進。在GBT 評估基礎上,WHO 進一步發布了列名監管機構(WHO Listed Authorities,WLAs) 標準和清單供全球參考,其本質上是一種國際資質認可,目的是推進國際監管協同。
目前, 我國監管機構的國際化認可水平仍處于起步階段,疫苗國家監管體系先行一步,被WHO 評為監管成熟度水平(maturity level,ML)3 級;藥品國家監管體系尚未獲得相關認證。需要看到,我國藥品研發管線和上市新藥數量均穩居全球第二梯隊之首,藥品監管體系建設取得了飛躍式進步,但我國藥品監管決策結果尚不能在國際社會獲得認可,我國創新藥出口仍任重道遠。
1 WHO 致力于推動基于證據的國際協同
1.1 監管機構能力評估
根據藥品監管全生命周期各個環節監管能力、資源配備和監管要點的要求,WHO 將GBT 指標分為9 個模塊,62 個相關指標,268 個子指標[3], 從而基于證據實現對藥品、疫苗等醫療產品國家整體監管體系和相關組成部門的監管職能的系統性評估,即ML 評估。9 個模塊分別為:國家監管體系(National Regulatory System,RS)、注冊和上市許可(Registration and Marketing Authorization,MA)、臨床試驗監管(Clinical Trials Oversight,CT)、實驗室檢驗(Laboratory Testing,LT)、市場監管(Market Surveillance and Control,MC)、藥物警戒(Vigilance,VL)、監督檢查(Regulatory Inspection,RI)、機構許可(Licensing Establishments,LI) 及批簽發(NRA Lot Release,LR)。268 個子指標可進一步分為1~4級,其中ML4 級為最高級別指標,代表達到先進水平且已具備在持續改進的監管體系中應當具備的能力要素;ML3 級代表具備穩定、功能良好、一體化的監管體系,該級子指標數量最多,占比達56%,是逐步構建較為健全的國家監管體系并能夠實現充分履行監管職能的關鍵要素;ML1級和ML2 級代表存在監管體系某些要素及滿足部分執行基本監管職能的國家監管體系應當滿足的要求(表1)。
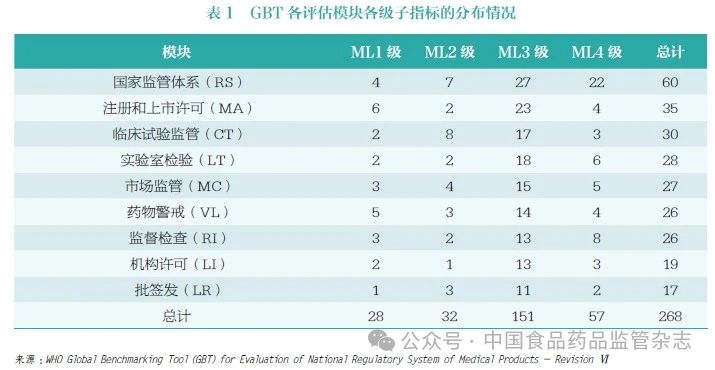
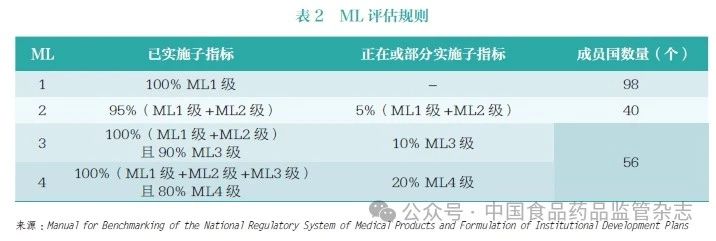
WHO 對監管機構的評估基于自愿原則,有意愿的監管機構提出申請, 隨后WHO 基于證據對申報監管機構每個級別子指標的完成情況進行評估,最終確認監管機構ML 水平。如以認證為ML3 級為評估目標,需要所有ML1 級和ML2 級子指標以及不少于90% 的ML3 級子指標達到完全實施。評估為ML3 級和ML4 級的監管機構代表有較高水平的監管能力。在WHO 194個成員國中,只有56 個(占比29%)被認為能夠達到ML3 級和ML4 級, 其他138 個( 占比71%)監管體系欠佳(表2)[2]。
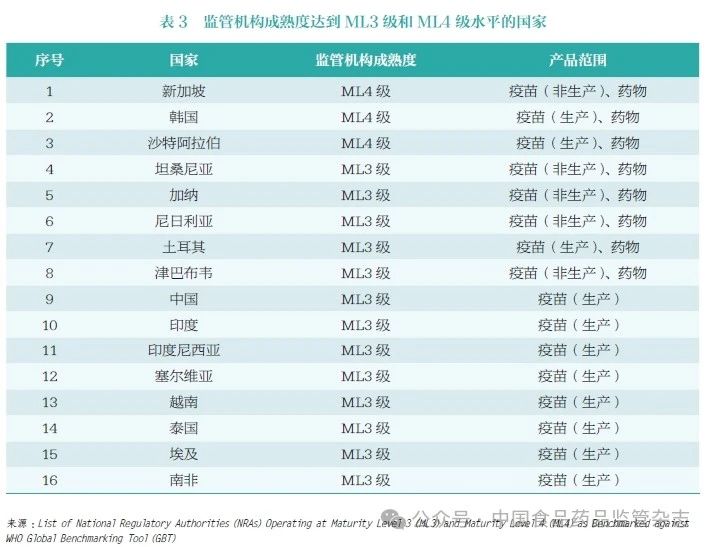
目前,全球僅有16 個國家正式申請并通過了WHO GBT 評估, 被評為ML3 級或ML4 級,涉及16 個疫苗監管體系、8 個藥品監管體系(表3)。其中,新加坡藥品監管機構積極推動,成為全球首個獲WHO 最高評級(ML4 級)國家監管機構;韓國、沙特阿拉伯是全球唯二同時在藥品和疫苗(生產)方面達到ML4級水平的國家;另有土耳其、加納、尼日利亞、坦桑尼亞、津巴布韋5 個發展中國家的疫苗和藥品監管體系達到ML3 級水平。2022年,我國第3 次通過WHO 疫苗領域評估,確認疫苗國家監管體系達到ML3 級水平[4]。當然我國在藥品監管體系成熟度方面仍有較大提升空間,未來在藥品國際化認可方面仍有較長的路要走。
1.2 達到ML3 級和ML4級是列為WLAs 的前提
GBT 評估是監管機構在全球范圍內進行統一評估的基礎,能有效識別監管機構的優勢與差距,并幫助其進行持續改進。WHO認為出于推進全球化監管信賴與依賴的目的,需要引入一套更加全面的監管機構評估體系,以促進監管機構之間的合作和信息共享,加強全球監管體系的連通性和一致性。經GBT 評估并公開為ML3 級和ML4 級的監管機構,再次評估符合WHO WLAs 要求后,代表該國家監管體系在質量和標準上達到了國際水平,可被列為WLAs,以供全球參考。
因此,WLAs 誕生的重要意義在于逐步取代以往WHO 各個指導原則、技術標準, 以及在全球采購和國際監管互信與依賴實踐中廣泛運用的嚴格監管機構(Stringent Regulatory Authorities,SRAs)的概念。同時,由于WLAs 是建立在證據基礎上的推動國際認可、互信的體系,在監管能力方面,WLAs 與SRAs 名單內機構監管能力相同,且在監管透明度和基于證據進行決策方面優于SRAs[5]。
在國際協調與互信實踐中,GBT 評估和WLAs 列名在全球推廣應用效果良好。例如,WHO 引入WLAs 用以替代SRAs,成為WHO 秘書處和全球基金各種全球藥品采購程序的可信賴監管機構庫;東盟聯合評估程序將參考國家監管機構資質條件設置產品分類為獲得WHOPQ 認證產品、SRAs 名單中國家監管機構批準產品以及被評為ML3 級或ML4 級的監管機構批準產品。
1.3 WLAs 效能評估框架概述
WLAs 效能評估框架( performance evaluation framework,PEF) 是在GBT基礎上建立的( 圖1)。國家監管機構(national regulatoryauthority,NRA) 及監管機構(regulatory authority,RA) 若想被列為WLAs, 除需要通過GBT 評估外, 還需要通過3 項評估程序:①滿足相關模塊中所有GBT ML3 級子指標(151 個)和強制性的GBT ML4 級子指標(36 個) 要求,ML3 級和ML4級監管機構若想被列為WLAs,則必須符合特定ML4 級子指標要求。②滿足相關模塊中的效能評估(performance evaluation,PE)指標要求。③滿足相關模塊中PE 工具要求。
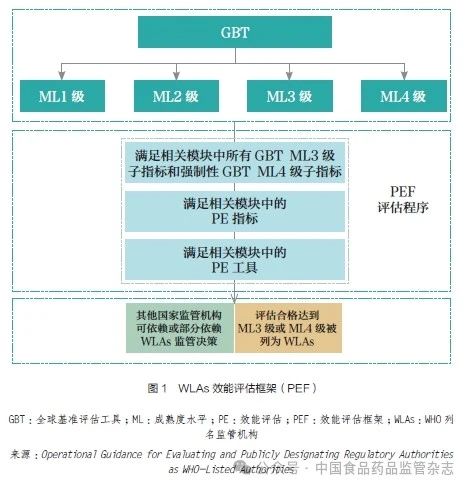
GBT 中ML3 級和ML4 級子指標的設置致力于促進藥品監管質量管理規范(good regulatory practice,GRP)的實施,關注風險管理理念和外部控制機制,以保證國家監管的效率、透明度、一致性及靈活性。PE 指標關注監管體系中所有監管機構的職能實施和產出,在實際評估過程中,監管機構能夠提供的證據越多,評估流程就越快。利用PE工具根據不同模塊的特點進行評估,如:針對MA、CT 及LT 模塊設計專家評估量表,組建專家小組進行評估;針對VL 模塊進行實地考察;針對RI 模塊通過設計檢查員評估量表對GxP 實施執行過程進行觀察審計。由此形成了WLAs PEF,根據相應的要求,監管機構經評估合格后即可被列為WLAs。
此外, 對于SRAs 等通過WHO 以往其他認證資質的監管機構,則可采用簡化的PEF 評估程序,經評估合格后被列為WLAs。2024 年5 月20 日,WHO 更新了正式WLAs 清單,涉及34 個國家和地區的監管機構,包含美國食品藥品監督管理局、歐洲藥品管理局、歐盟各國國家藥品監管機構、韓國國家藥品監管機構、新加坡國家藥品監管機構等[6],這表明WLAs 正逐漸取代SRAs,成為新一輪的國際認證趨勢。
2 WHO 框架下監管協同的特點
2.1 WLAs 評估指標關注重點
在長期應對全球復雜監管環境帶來的挑戰中,WHO 認識到無論成員國監管機構的規模和監管成熟度如何, 促進國際協同、信賴始終是加強全球監管體系能力和效率建設最核心、有效的戰略方法。協同、信賴建立在證據之上,WLAs 正是提供了這樣一個基于證據的、透明的框架, 來為指定的監管機構獲得全球認可奠定科學的循證基礎。因此,WLAs 評估關注的重點內容極具參考意義,能夠幫助監管機構更快、更深地融入全球化監管體系。
筆者對上述所有強制性ML4級子指標和PE 指標進行了梳理,匯總了各模塊中強制性ML4 級子指標和PE 指標的評估關注點(表4)。兩者關注重點有所不同,但又高度相似,主要集中在監管公開透明、監管活動質量和效率、風險管理理念等方面。
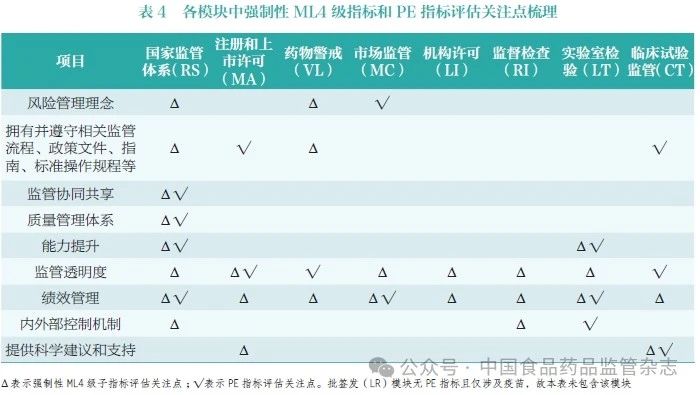
2.2 WHO 高度重視監管體系透明度
監管活動和決策的透明度是在全球和區域建立信任、實現依賴以及提高監管效率的重要推動力量,因此,WHO 將其作為WLAs體系組成的一個重要領域[7]。首先,在藥品監管體系GBT 評估中,每一模塊均有專門的系列指標用于考察監管體系透明度;其次,WHO 強調整個監管體系的公開透明,而不僅局限于監管決策信息的公開;最后,以促進全球和區域監管信賴與協同為目標的WLAs 框架體系中,透明度亦是其考察重點。
筆者以國家監管體系(RS)為例, 對該模塊所有涉及提高監管活動透明度的GBT 子指標、PE 指標進行了梳理,具體見表5。

3 我國藥品監管體系面臨的挑戰
公開、透明的監管體系不僅是對本國公眾、產業和政府負責,也是開展良好合作與協調的基礎,有利于推進國際監管協同。對標WHO 關于國家監管體系(RS)模塊的指標要求,我國自2015 年以來貫徹落實一系列變革性實踐,藥品監管科學性、可預期性、規范性全面升級,藥品監管透明度建設取得了飛躍式進展,如《藥品管理法》從法律法規角度強調對批準上市藥品的審評結論和依據以及產品召回信息的公開,符合WHO GBT 中子指標“RS01.06”要求。當然也需要看到,我國藥品監管體系仍存在一些優化調整空間。
3.1 關鍵決策信息公開還不夠全面
根據WHO WLAs 要求,子指標“RS09.03” 屬于強制性ML4 級指標,必須完全實現,即NRA 必須系統地公布積極和消極的監管決定。同時,GBT 工具指南也指出,一些國家法律規定不允許公布負面的監管決定,在這種情況下,評估可以僅限于公布積極的監管決定[3]。我國法律法規并未有此類規定,但在一些方面,如上市許可環節,國家藥品監督管理局(National Medical Products Administration ,NMPA)僅公布積極的批準上市決策和依據,對于不批準上市和終止加快上市等負面情況有時未及時公布。
對于已公布的信息,WHO要求公眾能夠獲得監管流程中支持最終決策的所有信息和報告。同樣以注冊上市環節為例,2020 年國家藥品監督管理局藥品審評中心(Center for Drug Evaluation,CDE)發布《藥品審評審批信息公開管理辦法》[8],詳細闡述了技術審評環節信息公開內容,我國藥品審評工作透明度取得了巨大進展。同時,專家咨詢委員會在藥品注冊審評工作中發揮專業優勢,有力支持我國藥品審評工作的開展[9]。然而,與CDE 審評環節高度透明化不同,盡管我國藥品注冊審評專家咨詢委員會名單是向社會公示的,但專家評審意見是保密的,這不完全符合WHO 及國際社會推行的提高監管透明度的理念,逐漸成為推動國際監管互信的重要掣肘因素之一。
3.2 公開信息的維護需進一步加強
子指標“RS09.04”“RS09.05”“RS09.08”“RS09.09”分別從信息發布、維護、信息公開工具與媒介角度對國家監管體系的公開透明度提出了要求。
當前,我國藥品監管信息基本能夠做到及時高效公開。例如, 根據子指標“RS09.04”的要求,NMPA 每季度更新發布藥品編碼本位碼, 公開上市產品相關授權、生產等信息,以促進對監管過程透明度的支持。根據子指標“RS09.09” 的要求, 國家藥品監管信息主要通過門戶網站方式進行公開, 利益相關者可以通過檢索直接查詢其所需要的法律法規、指導方針及監管決策等信息。
根據子指標“RS09.05”的要求,國家監管體系應當有書面文件或信息發布指南,規定發布信息的類型、格式、負責人及更新頻率,以便公眾能夠查閱到最新更新的信息。為完善藥品監管信息公開制度,NMPA 定期開展年度直屬事業單位網站評估工作,作為藥品監管的兩個重要職能部門,CDE 和國家藥品監督管理局食品藥品審核查驗中心(Center for Food and DrugInspection,CFDI) 分別發布了《藥品審評審批信息公開管理辦法》和各年度信息公開工作年度報告,以提升信息公開質量,提高藥品監管的透明度。需要注意的是,當前除《政府信息公開條例》外,我國已有的信息公開指南仍有待細化和健全,公開信息被審查和更新頻率、信息公開的范圍等內容應當予以明確。此外,新舊指導原則銜接性和時效性需進一步優化,部分已廢止指南未進行標注,造成查詢和使用不便。
在實操層面,近年來我國數字化產業發展迅速,有待高效應用于藥品監管領域,盡管子指標“RS09.08”只屬于一般性ML4級子指標,并不要求強制性執行,但WHO 在評估體系中反復強調藥品監管電子數據庫的建立、應用和共享,我國建立統一的藥品監管數據庫、強化藥品科學監管建設任重道遠。
3.3 監管流程及規則的透明度有待提高
監管流程及規則的公開、可預見也是提升藥品監管活動透明度的重要方面。根據子指標“RS09.02”的要求,有關監管部門應當確保公眾和利益相關者能夠獲得醫療產品的法律法規、指南和程序的信息。隨著藥品審評審批制度改革持續深化,國家不斷推進藥品全生命周期監管相關法律法規、部門規章、技術指南等的制定與頒布,公眾和利益相關者可便捷地通過門戶網站查詢使用,我國藥品監管可預期性大大提升。
以技術指導原則為例,為規范藥品研發過程,指導產業研發走向高質量發展道路,2015 年以來,CDE 不斷加強共性和個性技術指導原則制定工作。但從技術指導原則制定計劃角度來看,我國尚未公布每一年度擬修訂及制定原則主題清單,使得產業無法更廣泛地參與并提出相關建議及從產業角度進行監督;從技術指導原則整體數量和體系分類上來看,2015 年以來,CDE 已累計發布技術指導原則約400 個,其中共性技術指導原則覆蓋有效、多學科、安全性等方面與美國基本一致,但在質量相關共性和個性技術指導原則整體數量和體系分類上仍有明顯差距,相關指導原則的制定需要更加細化[10],以增強藥品研發生產過程規則的清晰性;從技術指導原則發布效率來看,我國在國際人用藥品注冊技術協調會(ICH)指導原則轉化方面仍需加速,部分草案與最終指導文件的發布時間相隔較遠,需要進一步提升制定和發布效率。同時,率先發布相關指南可能會對國際規則的制定產生重要影響,我國藥品監管部門還需持續保持未來發展戰略目光,加速前沿技術領域指導布局。
3.4 尚未邁出與海外監管機構信息共享步伐
從提升藥品監管規則透明度以增強國內外監管機構間信賴的角度來看,國家監管體系可以從兩方面發力。一是積極參與所在區域或全球協作組織信息共享、監管趨同和協同活動(符合子指標“RS09.01” 要求), 轉化落實已獲得廣泛認可的國際標準,參與新的監管標準的制定,在推動國家監管規則加速與國際接軌的同時,增強新興技術監管的透明度。二是建立適當的法規、指南及標準操作規程,從而支持與海外監管機構共享監管信息(符合PE 指標“PE.RS.04”要求),在國際合作中提高效率,促進更透明的監管決策。
近年來,NMPA 的身影始終積極活躍在藥品監管國際協調組織工作中,我國在與ICH 國際標準和規則接軌方面取得了豐碩成果。同時,面對新興技術帶來的機遇與挑戰,我國需要更加重視提升監管國際化水平,探索促進全球協作網絡下的融合。
在與國際社會交流與合作方面,NMPA 與60 余個國家和地區藥品監管機構建立了工作聯系,并與印度尼西亞、韓國、德國、英國、巴西、意大利等近30 個國家和地區的藥品監管機構簽署了30 余份合作文件[11],以加強藥品監管機構之間法律法規和監管信息交流。總體而言,我國與海外藥品監管機構的信息和工作共享還有待深入,指導國際交流與合作的相關法規、指南和程序尚未建立,合作形式較為單一,監管信息共享機制有待真正建立。
4 對于我國進一步融入全球監管體系的思考
從當前藥品監管全球化協同趨勢來看,推動我國藥品監管體系獲得國際認可至關重要,這將有利于展現大國擔當,推動我國創新藥品國際化,廣泛惠及全球人民。對于我國而言,藥品監管部門參與WHO WLAs 藥品監管體系評估和列名,正是為提升我國藥品監管在國際的聲譽和影響力提供了重要機會。未來,我國仍需以更深層次的變革、更高水平的開放建立科學高效權威的藥品監管體系,迎接國際化發展帶來的機遇與挑戰。
建議進一步完善頂層制度設計,提高對藥品全生命周期監管信息公開的重視程度。數據具備可分享性才更具價值,建議藥品監管部門建立數據管理機制,確保臨床試驗數據、檢查數據、藥物警戒數據等真實、準確、完整和可追溯。如此,既有助于提高我國藥品監管質量和效率,提高行業聲譽,又能挖掘數據的潛在價值,助力中國醫藥創新。
對于關鍵決策信息,建議全面公開,包括積極和消極的監管決策結果,也包括對決策起到決定性作用的依據。這不僅有利于提高監管決策的透明性,也有利于規范決策者的行為,科學高效問責。例如在上市許可環節,藥品監管部門除了公布批準的產品信息及其技術審評報告外,還應當公布撤回、拒絕及專家審評意見等信息。
對于提升藥品監管可預期性,建議持續細化完善相關政策法規、技術指導原則等。近年來,我國藥品監管部門不斷落實改革成果,在監管實踐中積累了豐富的經驗和共識。同時需要看到,部分領域可對外公開的文件和指南有待進一步落實,從而有利于規范和引導新藥研發,以及統一各地監管標準和尺度。
在加強我國藥品監管體系在全球的影響力和話語權方面,核心在于持續深化藥品監管改革,提升藥品監管能力建設。建議在參與全球和區域協作組織時發揮更大的主觀能動性,深耕已有平臺或創建新的國際協作平臺,牽頭前沿技術和新興領域的探索與國際規則的制定和探討,積極參與國際監管協作網絡決定和決議,促進在全球和區域協作組織框架下的融合、協調、協作和依賴。同時,建議藥品監管部門在已有的與海外監管機構戰略合作框架基礎上,探索監管機構間信息和工作共享與交流機制,促進監管機構間從建立相互受理,到藥品檢查互認協議的簽訂與執行,再到實現互信。
此外,建議制定并頒布相應的指南和文件,明確和細化藥品監管法律法規等的公開方式和程序,以及決策信息公開的類型、范圍、方式、更新頻次等,建立公開信息的維護和考核工作機制,進一步提高信息公開工作質量及其透明度。
在持續深化藥品監管改革的新時期,我國融入全球監管體系應當具有新的內涵、邁上新的臺階,相關政策制定者應當具備更加廣闊的國際化視野和自我革新精神,時刻關注國際藥品監管動態,及時根據國情調整本國政策,塑造中國藥品監管體系的國際新形象,助力中國創新藥品和藥品監管體系走出國門、走向國際。
第一作者簡介
張帆,碩士,中國醫藥創新促進會,分析師。專業方向:監管科學、國際化
通訊作者簡介 宋瑞霖,博士,中國醫藥創新促進會,執行會長。專業方向:產業政策、醫療保障、藥物政策及藥品監管
參考文獻:略
免責聲明 本文系轉載,僅做分享之用,不代表平臺觀點。圖片、文章、字體版權等均屬于原作者所有,如有侵權請告知,我們會及時處理。
原文鏈接:https://mp.weixin.qq.com/s/jtOast2u0m3qDoH1T-3wiQ
作者:張帆,宋瑞霖,等